给蛋白质装“逻辑大脑”!Nature 子刊突破:精准给药像编程,多重验证不误伤健康细胞
| [日期:2025-10-14] | 作者:生物谷 次浏览 | [字体:大 中 小] |
精准医疗时代,“药物误伤” 始终是难以突破的瓶颈——传统化疗像 “乱枪打鸟”,杀死癌细胞的同时也会攻击毛囊、消化道黏膜等健康细胞,导致脱发、恶心等严重副作用;据统计,全球每年因药物不良反应死亡的人数高达数十万。
如今,华盛顿大学团队发表在《Nature Chemical Biology》的研究,给蛋白质装上了 “逻辑大脑”:这些能自主 “思考” 的智能蛋白质,可通过识别体内多种生物标志物的组合,像计算机执行 “与/或/非” 程序一样精准控制药物释放,为癌症等疾病的精准治疗打开全新局面。
传统靶向治疗的局限,在于过度依赖单一生物标志物。比如前列腺癌常用的标志物 PSA,在前列腺炎患者体内也会升高,仅凭这一个信号判断 “是否释放药物”,很容易误伤健康组织。
事实上,几乎没有疾病拥有 “独一无二” 的生物标志物,就像手机解锁需要密码 + 指纹双重验证,真正的精准给药,也需要同时识别多个 “疾病信号”。早在 2018 年,科学家就提出将布尔逻辑(计算机的基础运算规则)融入生物材料设计——通过不同的分子连接方式,让药物在 “满足 A 条件”“满足 A 或 B 条件”“同时满足 A 和 B 条件” 等场景下才释放。但当时的技术依赖复杂的人工化学合成,制备几毫克的逻辑分子需要数月,产量低、成本高,根本无法推进到实际应用。
合成生物学的发展,彻底打破了这一僵局。研究团队发现,利用两种关键生物工具,能让智能蛋白质实现 “自主组装”:一种是 SICLOPPS 技术,通过分裂内含肽的自剪接功能,让蛋白质在细胞内自发首尾相连形成环状结构;另一种是 SpyTag/SpyCatcher、SnoopTag/SnoopCatcher 等 “分子胶水”,能让蛋白质片段之间形成稳定的异肽键,像乐高积木一样拼出复杂拓扑结构。
更关键的是,这些智能蛋白质的结构可以通过 DNA 序列 “编程”——研究人员只需设计好 DNA 蓝图,导入大肠杆菌等微生物中,微生物就能像 “活体工厂” 一样批量生产目标蛋白质。原本需要数月的人工合成流程,现在几周就能完成,产量还能达到每升培养液 20-50 毫克,彻底解决了规模化生产的难题。
这些智能蛋白质的 “逻辑决策” 能力,藏在它们特殊的分子拓扑结构里。研究团队设计了 17 种不同逻辑功能的蛋白质,覆盖了 “与 / 或 / 非” 的所有组合:比如 “YES 门” 蛋白质,只需识别一种蛋白酶(如 eSrtA (2A9))就能释放药物;“OR 门” 蛋白质有两个串联的蛋白酶识别序列,只要其中一种蛋白酶存在就能触发释放;“AND 门” 蛋白质则是环状结构,需要两种蛋白酶同时切割两个 “环臂”,才能让药物脱离载体。通过层级嵌套这些基础逻辑,研究人员还构建出更复杂的 “五输入系统”——只有当五种特定蛋白酶同时存在时,药物才会释放,这种精准度几乎能做到 “只认癌细胞,不碰健康细胞”。
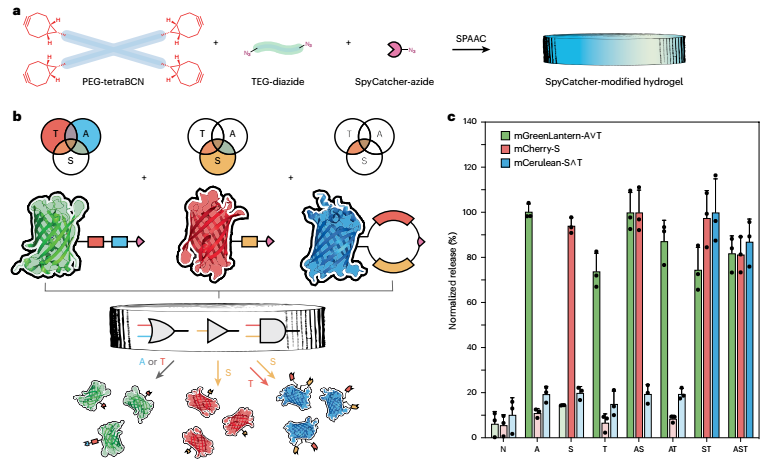
图:自主编辑的分子拓扑使不同的蛋白质能够从水凝胶网络中多路传输并独立触发释放
在实验中,这些智能蛋白质展现出惊人的应用潜力。在水凝胶载体中,研究人员同时装载了三种不同的荧光蛋白:mGreenLantern-A∨T(识别两种蛋白酶中的一种就释放)、mCherry-S(只识别一种蛋白酶)、mCerulean-S∧T(需要两种蛋白酶同时存在),结果三种蛋白质能严格按照预设逻辑独立释放,互不干扰。
更令人兴奋的是,它们还能在活细胞上 “精准定位”:针对 HER2 阳性乳腺癌细胞,研究团队设计了 “C∧(A∨T)” 逻辑的纳米抗体-荧光蛋白复合体——只有当细胞同时表达 HER2 抗原,且不存在特定切割蛋白酶时,荧光信号才会锚定在细胞膜上;通过流式细胞术验证,这种逻辑控制的细胞标记准确率超过 97%,几乎没有误标情况。
除了药物输送,这项技术还能延伸到多个领域。在诊断方面,可开发能检测血液中多种生物标志物组合的试纸,比如同时识别肝癌的 AFP、PIVKA-II 两种标志物,大幅降低误诊率;在细胞工程领域,研究人员已成功在 HEK293 细胞内表达 “C∨(T∧V)” 逻辑的蛋白质,让其根据细胞内蛋白酶信号,在细胞膜和细胞质之间精准定位,未来有望用于细胞内疾病的靶向治疗;在组织再生中,还能设计随伤口愈合进程释放生长因子的支架——初期释放促进炎症消退的因子,后期释放促进细胞增殖的因子,实现 “按需给药”。
研究团队表示,癌症治疗将是这项技术最先落地的场景。目前他们已针对多种癌症的特异性蛋白酶组合设计了逻辑分子,下一步将结合更多疾病标志物,开发能在体内 “自主判断病情、精准释放药物” 的治疗系统。未来,医生给患者开具的可能不只是药物,还有控制药物释放的 “逻辑程序”——比如针对某类肺癌患者,设定 “只有同时检测到 EGFR 突变蛋白 + 肿瘤微环境酸性信号 + 特定炎症因子时,才释放化疗药物”,真正实现 “对癌细胞精准打击,对健康细胞零伤害”。
从 “一种药物治所有人” 到 “为每个患者定制药物逻辑”,这种可编程的智能蛋白质技术,正在改写精准医疗的未来。当药物能像计算机一样 “思考”,曾经困扰医疗界的 “误伤” 难题,或许将彻底成为历史。(生物谷Bioon.com)
参考文献:
Gharios, R., Ross, M.L., Li, A. et al. Boolean logic-gated protein presentation through autonomously compiled molecular topology. Nat Chem Biol (2025). doi:10.1038/s41589-025-02037-5